摘要
肠道内短链脂肪酸(short-chain fatty acids, SCFAs)浓度很高. 他们是微生物自身以及宿主肠上皮细胞(intestinal epithelial cells, IESs)的能量来源, 促进细胞生长, 降低结肠内环境pH值, 减少有害菌生长. 近年研究证实, SCFAs能够调节宿主肠道免疫力, 降低结肠炎症反应; 抑制结肠肿瘤细胞增殖、诱导肿瘤细胞分化和凋亡、影响原癌基因表达. 本综述将详述SCFAs通过G蛋白偶联受体激活途径和组蛋白去乙酰化酶抑制途径, 引起中性粒细胞和调节性T细胞应答, 降低结肠炎; 增强IESs屏障功能; 抑制结肠肿瘤增殖; 治疗非酒精性脂肪性肝病和肥胖.
哺乳动物体内存在复杂的微生物群落. 经长期共生适应, 宿主已可以通过协调和整合代谢信息、微生物感应、免疫应答途径确保自身与微生物和谐共存. 宿主与微生物群落间的动态调节对实现和维持机体稳态至关重要, 当动态调节失衡, 宿主就会产生疾患. 微生物代谢产物内短链脂肪酸(short-chain fatty acids, SCFAs)在人类某些疾病的发生发展中起着至关重要的作用. 研究SCFAs通过何种机制影响机体免疫应答与代谢反应对理解宿主-微生物共生并找到全新有效的疾病治疗途径具有建设性意义.
SCFAs又称为挥发性脂肪酸, 是由1-6个碳原子组成的有机脂肪酸. SCFAs的主要产生部位是结肠, SCFAs多是由未消化吸收的食物残渣中的碳水化合物经结肠内厌氧菌酵解产生, 主要包括乙酸、丙酸、丁酸(表1)[1,2], 其在结肠内的浓度约为20-140 mmol/L[3]. SCFAs的种类、数量主要取决于肠道内菌群组成、消化的时间、宿主-微生物代谢通量以及宿主食物中的纤维含量. 发酵所产生的SCFAs在人体内参与不同器官的代谢, 发挥不同的功效. 细菌发酵产生的乙酸可被宿主吸收利用, 是宿主能量的重要来源, 提供人体日总能量的约10%; 丙酸经血液吸收后在肝脏中分解代谢, 参与丙酮酸逆转化为葡萄糖的过程, 同时可能抑制脂肪的合成; 丁酸主要被上皮细胞利用, 是上皮细胞的主要能量来源[1,4].
| 细菌类型 | 代谢产物 |
| 拟杆菌类 | 乙酸、丁酸、琥珀酸 |
| 乳杆菌类 | 乳酸 |
| 链球菌类 | 乙酸、乳酸 |
| 真杆菌类 | 乙酸、丁酸、乳酸 |
| 双歧杆菌类 | 甲酸、乙酸、乳酸 |
| 消化链球菌类 | 乙酸、乳酸 |
| 梭菌类 | 乙酸、丙酸、丁酸、乳酸 |
| 瘤胃球菌类 | 乙酸 |
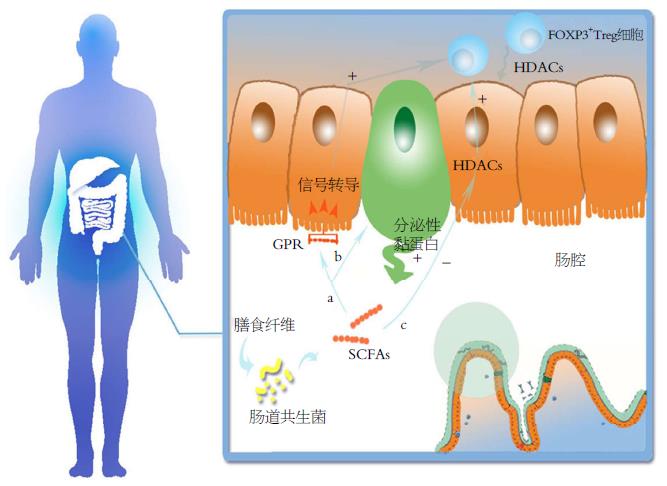
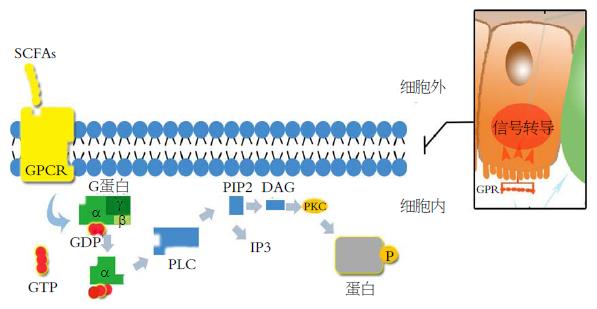
有研究[5]表明, 连续5 wk给予慢性辐射性直肠炎患者含SCFAs的灌肠液后, SCFAs灌肠组患者与对照组相比直肠出血天数以及出血范围减少, 血红蛋白量增加, 慢性辐射性直肠炎有所康复[5,6]. Scheppach对溃疡性结肠炎患者给予SCFAs灌肠8 wk后, 肠道炎症得到改善[7]. 可见, SCFAs具有降低肠道炎症反应的作用. SCFAs通过G蛋白偶联受体(G protein-coupled receptors, GPCRs)激活途径和组蛋白脱乙酰基酶(histone deacetylases, HDACs)抑制途径两条信号通路发挥抗炎作用[8,9](图1, 2). SCFAs既可以直接影响HDACs, 也可以通过与GPCRs作用间接影响HDACs.
SCFAs是HDACs的天然抑制剂. SCFAs对HDACs的抑制作用取决于SCFAs的浓度, 只有高浓度的SCFAs才能抑制HDACs. 例如乳酸作为合成丁酸的底物, 在高浓度下能抑制HDACs的活性(半数抑制浓度IC50为40 mmol/L), 但只有在高强度训练下的肌细胞中乳酸才能达到这一浓度, 因此肠道内的乳酸不能抑制HDACs; 同样, 其他SCFAs或细菌代谢产物, 如丙酮酸, 尚未达到有效抑制上皮细胞内HDACs功能的浓度[10]. Cox等[11]发现, SCFAs若能发挥抗炎作用, 其浓度必须要达到毫摩尔级. 正常情况下, 血液循环中的SCFAs水平很低, 不能达到毫摩尔级, 丁酸和丙酸的浓度只有微摩尔级, 无法起到抗炎作用[12]. 但机体产生炎症后, 体内某些致病菌可以产生SCFAs, 使感染位点的SCFAs浓度提升到毫摩尔级, 启动免疫细胞的抗炎作用[12,13].
中性粒细胞是向炎症性部位聚集的第一种效应细胞, 他们内吞并杀死细菌和真菌. 中性粒细胞在炎症应答中产生肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)、白介素(interleukin, IL)-1β、IL-8, 调整炎症应答的多个环节[14]. 中性粒细胞被脂多糖激活后释放TNF-α, 有研究[3]证实SCFAs抑制HDACs活性, 从而降低脂多糖应答反应, 中性粒细胞激活受到抑制, TNF-α释放量减少, 从而起到抗炎作用. SCFAs还可以抑制核因子-κB(nuclear factor-κB, NF-κB)通路阻滞炎症细胞分泌IL-2、IL-6、TNF-α等炎性因子[15,16]. 因此, SCFAs引起的外周血单核细胞和中性粒细胞应答包括: 灭活NF-κB, 下调多种炎症因子.
有研究[17]表明给小鼠饲喂含SCFAs的饮食可提高FOXP3+Treg细胞(regulatory T cells, Treg cell)的抑制功能, 从而能抑制结肠炎症的发生. Treg细胞表达多种HDACs, 其中HDAC9对调节依赖FOXP3+的免疫抑制功能最为重要[18]. 抑制HDAC9会引起FOXP3+Treg细胞数量增加, 增强FOXP3+Treg细胞的免疫功能, 降低小鼠内Treg细胞介导的结肠炎[18](图1). 研究[19-21]已证明特定的SCFAs可以调整结肠的FOXP3+Treg细胞的数量和功能, 保持结肠稳态. 产妇摄入富含SCFAs的食物可将抑制效应传递到子代, 说明了SCFAs在免疫系统发展和预防疾病方面具有一定遗传性[22].
给予含有SCFAs的饮用水可增加野生型小鼠体内诱导型FOXP3+Treg细胞的数量和功能从而减弱小鼠的病情, 但Gpr43−/−小鼠的病情没有减弱[20,23], 说明SCFAs降低肠道炎症需要GPCRs介导. GPCRs由人类染色体基因19q13.1表达[12]. 现已发现SCFAs的特异性受体有GPR41/43以及GPR109A. 许多类型的细胞都会表达GPCRs. GPR41/43主要在肠内分泌细胞、脂肪细胞、多形核细胞和巨噬细胞表达[9,24], GPR109A在结肠细胞、脂肪细胞和肝细胞表达[9,25]. GPR43与SCFAs结合后可引起中性粒细胞向炎症部位趋化[6]并影响Treg细胞的增生和功能[20]. G蛋白偶联烟酸盐受体(G-protein coupled nicotinate receptor, GPR109A)是烟酸和丁酸的受体, SCFAs与GPCR109A结合后可诱导Treg细胞和分泌IL-10的T细胞分化, 从而抑制结肠炎的发生[25,26]; 还会引起肠细胞内环磷酸腺苷水平下降, 减少对电解质和水的吸收, 减轻炎症性肠病的腹泻症状[27]. 有文献报道SCFAs可与肠上皮细胞(intestinal epithelial cells, IESs)GPR43和GPR109A结合促进IL-18的分泌[28,29], 减轻DSS致损伤模型和T细胞转移结肠炎模型中结肠炎的病理变化[29]; 还可促进肠道上皮细胞K+外流, 肠道上皮细胞膜发生超极化, 进而激活NLRP3炎症小体, 起到减轻肠炎的作用[9,30]. 可见, SCFAs及其受体在抗炎过程中起着重要的调节作用.
无菌小鼠内接种多形拟杆菌和普氏粪杆菌会诱导杯状细胞分化并产生大量黏液[31]. 肠黏膜的黏液层是抵御肠腔内容物的机械性、化学性和微生物性攻击的第一道屏障. 黏液主要是由黏蛋白多聚糖组成的, 黏蛋白由MUC基因(mucin genes)编码. 至今为止, 已经在人体内至少发现了15种不同的MUC基因. 在大肠内, 黏蛋白主要由MUC2基因编码, MUC1、MUC3、MUC4基因也有少量表达[32,33]. MUC2基因编码结肠内主要的分泌性黏蛋白, 而MUC1、MUC3、MUC4基因主要编码位于膜上的黏蛋白[34]. 有研究[35,36]显示, 在富含葡萄糖的培养基中, 丁酸可以明显提高MUC3和MUC5的表达; 在葡萄糖缺乏的培养基中, 丁酸是唯一可获得能源的物质, MUC3、MUC5、MUC5AC和MUC2的表达量均大幅提高. 这项研究还证明丁酸可以在转录水平提高结肠杯状细胞黏蛋白的分泌量(图1).
动物实验证实, 在全肠外营养大鼠模型中, 静脉给予SCFAs(每1000 mL完全肠外培养液中含乙酸钠36 mmoL、丙酸钠15 mmoL、丁酸钠9 mmoL)可以有效维持肠绒毛高度、宽度、隐窝深度、黏膜厚度, 增加肠黏膜细胞增殖能力, 减轻三磷酸吡啶核苷酸所致的肠黏膜萎缩, 维护肠黏膜形态, 维持IESs完整性[37]. 这是因为SCFAs是肠黏膜营养物质之一, 为IESs提供60%-70%能量, 可促进IESs增生从而修复肠黏膜. 实验证实无菌鼠肠道细胞明显能量供应不足, 甚至出现自噬现象, 破坏肠道上皮的完整性, 但对小鼠饲喂含丁酸的食物后, 肠道上皮细胞的形态和结构恢复正常[38]. SCFAs还可以促进肠细胞分泌胰高血糖素样肽2(glucagon-like peptide-2, GLP-2), GLP-2是一种肠上皮特异性生长因子, 能促进肠黏膜的生长及修复肠上皮损伤, 提高肠黏膜屏障功能[39].
此外, SCFAs可以促使细胞机械屏障分子ZO-1蛋白和occludin蛋白-5表达增加, 促进IESs间紧密连接的形成加强IESs屏障功能, 降低肠道通透性, 减少有害物质(如脂多糖LPS)入血. 出血性大肠杆菌侵袭Caco-2细胞时, 乙酸可维持上皮的完整性[40], 肠道内双歧杆菌株产生的醋酸有助于抵御大肠杆菌O157:H7感染[41], 这都与SCFAs增强IESs屏障的完整性并抑制毒素吸收有关.
大量研究证实SCFAs能抑制结肠肿瘤细胞增殖分化、诱导肿瘤细胞凋亡. 陈尔真等[42]对体外培养的已建株的人结肠癌细胞株SWIII6给予不同浓度的丁酸处理, 结果显示丁酸能抑制SWIII6的增殖, 随着丁酸浓度的增加和培养时间的延长, 抑制作用增强; 丁酸还能使SWIII6细胞的癌胚抗原和碱性磷酸酶表达量增加, 随着丁酸浓度的增加和培养时间的不断延长这两种表达物的增加量更为显著.
研究已证实丁酸拮抗HDACs, 使染色质乙酰化水平上调, 处于高转录活性的开放状态, 从而增加基因表达量. 用丁酸预处理结肠癌细胞系后, 发现研究的588个基因中有23个表达量明显上调, 其中P21基因转录水平增加4倍以上, 可知丁酸通过上调组蛋白乙酰化水平而提高P21基因表达量, 使细胞周期停滞在G0期, 抑制结肠癌细胞增殖[43]. Mandal等[44]将3 mmoI/L浓度的丁酸分别与人结直肠癌细胞株SW480、HCTll6、DiFi共同培养, 结果发现3种癌细胞中的凋亡细胞数均较未用丁酸处理组明显增加.